UV-Vis Spectroscopy는 저의 석,박사 과정을 함께한 아주 중요한 분석 장비, 기술입니다.
그럼 오늘은 UV-Vis Spectroscopy 시리즈의 시작으로 그 원리에 대해서 알아볼게요.

UV-Vis Spectroscopy란 무엇일까요?
UV-Vis Spectroscopy는 UV-Vis spectrometer 혹은 UV-Vis Spectrophotometer,
비공식적으로는 '유브이 장비', '유브이비스' 등등으로 간단하게도 불리기도 하지요.
이름에서 알 수 있듯이 UV-Vis Spectroscopy는 Ultraviolet (자외선) 과 visible (가시광선),
그리고 장비에 따라서는 NIR (near infrared, 근적외선) 영역의 빛을 이용하는 분석 장비입니다.
UV-Vis Spectroscopy는 Quantitative analysis(정량분석) 및 Qualitative analysis(정성분석)이 가능한 분석 기술로 다양한 연구분야에서 폭넓게 사용되고있습니다.
UV-Vis Spectroscopy의 활용 분야에 대해서는 나중에 좀 더 구체적으로 말씀드리도록 할게요.
그럼 우선 UV-Vis Spectroscopy 분석 원리에 대해서 자세히 알아볼까요?
먼저 전자기파(빛)에 의해서 발생하는 transition들에 대해서 다시 한번 집고 넘어가겠습니다.
3가지 Transitions
지난 Spectroscopy 게시물에서 이야기했던바와 같이, [2022.10.19 - [공부할 시간/분석장비] - Spectroscopy, 분광학]
UV 및 visible 영역의 빛은 상대적으로 강한 에너지를 가지고 있기 때문에 분자 내부의 Electronic transitions (전자전이)를 발생시킬 수 있습니다.
즉, UV-visible 영역대의 빛을 특정 분자에 조사하게 되면,
이 빛의 에너지를 흡수한 해당 분자의 최외곽 전자가 ground electronic states(바닥상태)에서 excited electronic states(들뜬상태)로 이동하게 되는 electronic transitions(전자전이)가 발생되게 되는것이지요.
지난번에 설명드렸듯이 빛과 같은 전자기파의 에너지는 파장에 따라서 달라집니다.
그렇다면 파장이 다른 빛을 다원자 분자에 조사하게 된다면, 빛의 에너지의 따라서 분자 내부에서 여러가지 변화들이 발생할 수 있겠죠?
다원자 분자의 경우, 빛 에너지를 흡수했을때 흡수한 에너지에 따라 크게 세가지 타입의 전이가 발생할 수 있습니다.

위 그림은 다원자 분자의 potential energy curves(퍼텐셜 에너지 곡선)을 보여주고 있습니다.
그래프의 가로축은 분자를 구성하는 원자의 핵간 거리, 즉 분자의 Bond length(결합길이)를 의미하고
세로축은 potential energy(퍼텐셜 에너지)를 나타내고 있지요.
1. Electronic transitions (전자전이)
그래프에서 파란 화살표는 UV 혹은 Visible 영역의 빛에 의한 electronic transition(전자전이)를 보여주고있습니다.
화살표의 시작과 끝을 보시면 ground electronic states에서 excited electronic states로 전자가 이동하는 것을 나타내고 있지요.
Electronic transition의 경우 화살표의 길이가 가장 긴것이 보이시지요?
이것은 electronic transition이 발생하려면 큰 에너지가 필요함을 의미하며, UV 혹은 visible 영역대의 빛이 이 electronic transition이 발생하는데 필요한 에너지를 제공할 수 있습니다.
2. Vibrational transitions (진동전이)
그리고 빨간 화살표는 vibrational transitions(진동전이)를 나타내며,
그래프에서 보시다시피 vibrational transitions는 같은 electronic states 내부에서 서로 다른 vibrational levels(진동준위) 간에 일어나게 됩니다.
Vibrational transitions같은 경우에는 화살표의 길이가 상대적으로 짧은데, 이것은 더 약한 에너지를 흡수하는것을 의미하며, infrared(적외선)영역 대의 빛이 이에 해당하는 에너지원을 제공합니다.
※ vibrational transitions은 FTIR (Fourier-transform infrared spectroscopy)과 Raman spectoscopy로 관찰할 수 있습니다. FTIR과 Raman에 대해서는 다음에 따로 정리를 한번 하겠습니다.
3. Rotational transitions (회전전이)
Rotational transitions(회전전이)의 경우 대부분 같은 vibrational state 내의 rotational levels(회전준위)간에 발생하며, 많은 분자들의 경우 vibration transitions과 rotation transitions이 동시에 발생하기도 합니다.
위 그림에서는 여러개의 선으로 나타내어져 있고, rotation transitions의 경우 microwave와 같이 아주 약한 전자기파에 의해 발생되게 됩니다.
이렇게 세가지 transition과 관련된 에너지의 상대적 크기를 비교해보자면 아래와 같이 나타낼 수 있겠지요?

다시 한번 정리하자면,
UV와 Visible 영역의 빛은 electronic transitions을
infrared radiation은 vibrational and vibration-rotation transitions을
그리고 microwave radiation는 pure rotational transitions을 발생시킵니다.
이 중, 오늘 다룰 UV/Visible radiation에 의한 electronic transitions을 더 자세히 한번 알아봅시다.
UV-vis에 의한 분자의 Electronic transitions (전자전이)
이를 위해서 먼저 간단한 분자 궤도 다이어그램 (Molecular orbital diagram)에 대해서 살펴보도록 하겠습니다.
아래 그림은 가장 간단한 구조의 분자인 수소분자의 molecular orbital diagram(분자 오비탈 그림)을 보여주고 있습니다.

수소분자(H2)의 공유결합은 수소원자(H) 두개의 atomic orbital의 overlap(겹침)에 의해 생기게 됩니다.
그림에서 보시다시피 수소원자(H) 두개의 1s orbital들이 수소분자(H2)의 두 molecular orbitals를 구성하게 되지요.
두 molecular orbitals 중, 하나는 높은 에너지를 갖는 antibonding molecular orbital(반결합성 오비탈)이고요.
다른 하나는 낮은 에너지를 갖는 bonding molecular orbital(결합성 오비탈)입니다.
※ 이와 관련해서 더 알고싶으시다면, Molecular Orbial Theory에 대해서 한번 찾아보시는걸 추천드립니다.
Antibonding molecular orbital 의 경우, 전자가 채워지지 않은 오비탈 중 가장 에너지 준위가 낮은 오비탈이기 때문에 Lowest unoccupied molecular orbital (LUMO)라고 불리며,
bonding molecular orbital의 경우, 전자가 채워진 오비탈 중 가장 에너지 준위가 높은 오비탈이기 때문에 highest occupied molecular orbital (HOMO)라고 불립니다.
수소분자보다 좀 더 복잡한 구조의 분자의 경우에는,
overlap되는 atomic orbitals의 갯수가 증가되기 때문에, 결과적으로 구성된 분자의 electronic states도 증가하게 되어서
아래 그림과 같이, 여러개의 서로 다른 에너지 준위를 갖는 molecular orbital들이 존재하게 되지요.

이때 빛이 이 분자를 통과하게 된다면, 빛에서 제공되는 에너지에 의해 bonding 혹은 non-bonding orbital에 있던 전자가
비어있던 antibonding orbital로 transition되게 됩니다.
이러한 전자전이에 필요한 에너지는 orbital 간의 에너지 준위 차이에 의해 결정됩니다.
즉, Electronic transitions를 일으킬 수 있는 적정한 특정 세기의 빛을 분자에 조사하게 되면,
해당 파장의 에너지는 분자에 의해 흡수되고 전자를 이동시키는데 사용됩니다.
우리가 UV-visible 영역의 빛을 사용할 때에 발생하는 electronic transition은 아래 그림에서 확인할 수 있습니다.

여기서 먼저 기억해야 할것은, 화살표의 길이가 긴 electronic transition은 더 큰 에너지 즉 더 짧은 파장의 빛을 흡수함을 의미한다는 것입니다.
n → π*, π → π*
: 200 - 600 nm 파장 영역의 빛이 필요합니다.
즉, UV-Vis Spectroscopy로 분석 가능한 electronic transition 입니다.
lone pair electrons과 multiple bonds를 가진 분자에서 관측 가능합니다.
n → σ*, π → σ*
: 150 - 250 nm 파장 영역의 빛이 필요합니다.
σ → σ*, σ → π*
: 150 nm 보다 작은 파장 영역의 빛이 필요합니다.
그럼 예를 한번 들어보겠습니다.

메탄 분자의 경우, C-H bond (σ bond) 4개만을 가지고 있는 아주 간단한 구조의 분자입니다.
때문에 메탄은 σ → σ* transition만이 가능하며, 이를 위해서는 125 nm 파장의 아주 강한 전자기파(빛)가 필요하게 됩니다.

하지만 (당근에 많이 들어있는) Beta-carotene(베타카로틴)의 경우,
아래와 같이 11개의 carbon-carbon double bond를 포함하는 복잡한 분자구조를 가지고 있고
double bond를 구성하는 π orbital의 전자는 상대적으로 약한 에너지에도 쉽게 transition 되기 때문에
결과적으로 470 nm 파장대의 빛을 강하게 흡수할 수 있게 됩니다.
이러한 Beta-carotene의 가시광선 영역대의 빛 흡수는 conjugation effect(비편재 효과)로 설명 될 수 있습니다.
Conjugation effect(비편재 효과)
Conjugation이란 '2개 이상의 다중결합이 단일결합을 하나씩 사이에 끼고 존재하며, 이들 결합이 상호작용을 일으키는 현상'을 말합니다.
즉 화학결합이 ...-=-=-=-...와 같이 이중(혹은 삼중) 결합과 단일결합의 반복으로 이루어졌을때의 경우를 의미하지요.
좀 더 구체적인 이야기는 아래 그림을 통해 알아보겠습니다.

위 그림은 4가지 서로다른 cojugation 길이를 가지고 있는 분자들의 HOMO와 LUMO 간의 Energy gap 차이를 보여주고 있습니다.
첫번째인 Ethylene과 같이 단 하나의 이중 결합을 가지고 있는 경우에는,
하나의 bonding orbital과 하나의 antibonding orbital이 각각 존재합니다.
또, conjugation 길이가 조금 더 긴 butadiene과 같은 경우에는 두개의 bonding orbital과 두개의 antibonding orbital이 존재하게 되겠지요.
이처럼 이중결합과 단일결합의 반복된 구조가 더 길어져 conjugation 구조의 길이가 증가하게 된다면,
bonding orbital과 antibonding orbital의 숫자가 증가하게 되고,
결과적으로 그림처럼 HOMO와 LUMO 간의 energy gap이 작아지게 됩니다.
HOMO와 LUMO 간의 gap이 작다는 것은,
HOMO에 있는 전자가 작은 에너지를 흡수해서 LUMO로 transition 될 수 있다는것을 의미하고,
이는 곧, UV가 아닌 상대적으로 약한 visible 영역대의 빛을 흡수하여 electronic transition이 가능하다는것을 말합니다.
이것이 왜 대부분의 색깔을 띄는 유기분자들이 길고 conjugation된 분자구조를 가지고 있는지를 설명해 줍니다.
보통 가시광선 영역대의 빛을 흡수하기 위해서는 적어도 8개 이상의 이중결합이 필요합니다.
위 그림의 octatetraene처럼요.
※ 유기물이 아닌 무기물의 energy transition에 대한 내용은 추후에 UV-Vis Spectroscopy의 활용에서 다루도록 하겠습니다.
UV-vis 흡수 데이터 예시
그렇다면 UV-visible absorption spectrum(UV-vis 흡수 스펙트럼) 분석 결과는 어떻게 생겼을까요?
대표적인 유기염료인 Methylene blue(메틸렌블루)의 예를 보여드리겠습니다.
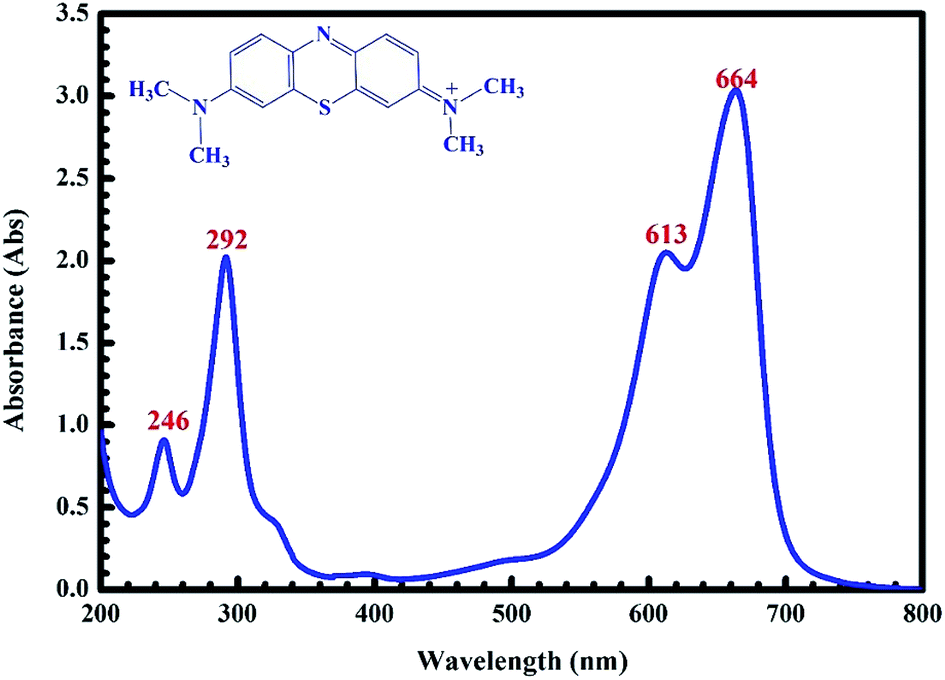
위 그래프는 Methylene blue의 UV-visible absorption spectrum을 보여주고 있습니다.
보시는 바와 같이, Methylene blue는 664 nm의 파장대 빛을 최대치로 흡수하고 있고,
그보다 짧은 파장대의 빛에서도 세가지 흡수 peak을 보여주고 있습니다.
이렇게 실제 상황에서는 분자들이 그 구조에따라서 (또한 용매, 안정제와 같은 주변 환경에 따라서) 여러가지 영역대의 빛을 특징적으로 흡수하게 됩니다.
그런데 여기서 조금 의아한것은 분자의 HOMO와 LUMO 간의 energy gap의 차이는 특정 값으로 정해져 있을텐데, (quantized, 양자화)
실제 UV-visible 흡수 peak은 생각보다 완만한, broad한 형태를 보인다는 것이죠?
그래프를 보시면 알 수 있듯이, 딱 664 nm의 빛만 흠수하는것이 아니라, 대략 620 - 700 nm의 빛을 흡수하고 있죠.
이것은 electronic transition외에도 vibrational 그리고 rotational energy levels도 UV-visible 흡수에 일부 관여하기 때문입니다.

위 그림에서 보시듯이 하나의 electronic energy level에는 여러개의 vibrational energy level들이 존재하고,
또 그안에서도 여러개의 rotational energy level들이 존재합니다.그렇게 때문에
electronic transition이 발생할 때에 전자가 존재하고 옮겨가는 energy level이 하나 이상으로 존재하게 되는것이지요.
이것이 UV-visible absorption spectrum의 peak가 하나의 sharp한 선이 아닌 borad하게 나타나는 이유입니다.
오늘 공유드린 내용이 유익하셨나요?
다음번에는
UV-Vis Spectroscopy의 활용분야 - 정량분석 (Calibration Curves 만들어서 Methylene Blue 농도 알아내기)
UV-Vis Spectroscopy의 활용분야 - 금속 나노입자의 UV-visible absorption (localised surface plasmon resonance)
UV-Vis Spectroscopy 장비의 작동원리
과 같은 내용들에 대해서 알아보도록 할게요.
여기까지 읽어주셔서 감사합니다.
좋은 하루 보내세요!
-엠마리-
'공부할 시간 > 분석장비' 카테고리의 다른 글
| UV-Vis Spectroscopy, 분광광도계 - 작동원리 (2) | 2023.02.25 |
|---|---|
| UV-Vis Spectroscopy - 나노입자 정성 분석 (Qualitative analysis of nanoparticles) - 국부적 표면 플라즈몬 공명 (LSPR), 레일리 산란 (Rayleigh scattering) (1) | 2023.01.09 |
| UV-Vis Spectroscopy - 나노입자 정성 분석 (Qualitative analysis of nanoparticles) - 반도체 나 (0) | 2022.12.12 |
| UV-Vis Spectroscopy - 정량분석 (Quantitative analysis) (0) | 2022.11.30 |
| Spectroscopy, 분광학 (1) | 2022.10.19 |




댓글